在美国,所有新的药品(包括疫苗)、医疗设备和治疗方法都要经过临床试验和FDA的审批同意后才能正式上市销售和使用。
那么,一种新药(疫苗)从临床试验到上市销售,要经过哪些过程呢?
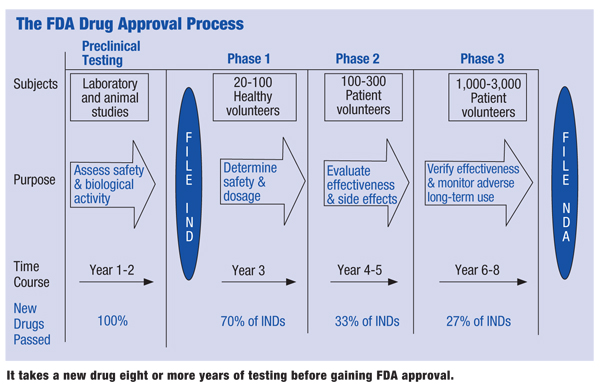
1、Pre-clinical stage 临床前研究阶段,临床前研究使用组织培养或细胞培养,以及动物试验来评估疫苗的安全性及其免疫原性或引起免疫反应的能力。
2、Investigational New Drug application(IND) 研究型新药申请,也就是药厂向美国FDA提出研究新药申请。
3、Phase I Vaccine Trials 临床试验一期,一小群(一般几十人)成年人接受疫苗试验,通常在20-80名受试者之间。 如果疫苗是针对儿童的,研究人员将首先对成年人进行测试,然后逐步降低测试对象的年龄,直到他们达到目标为止。
4、Phase II Vaccine Trials 临床试验二期,扩大临床研究范围(一般为几百人),并向具有与新疫苗相似的特征(例如年龄和身体健康)的人群提供疫苗试验。II期临床测试的目的是研究疫苗的安全性、免疫原性、建议的剂量、免疫时间表等。
5、Phase III Vaccine Trials 临床试验三期,提供疫苗给几千到上万的人测试,并进行功效和安全性测试。III期试验是随机且双盲的。
6、上市批准,在成功的III期临床试验之后,疫苗开发公司将向FDA提交《生物制剂许可申请》。 然后,FDA将检查生产疫苗的工厂,并批准疫苗的标签。疫苗正式可以上市销售。
疫苗获得上市许可后,FDA将继续监视疫苗的生产,包括检查设施并审查制造商对许多疫苗的效力、安全性和纯度的测试。 FDA有权对制造商的疫苗进行自己的测试。
7、Post-Licensure Monitoring of Vaccines 疫苗的批准授权后监测,批准疫苗后,FDA还将多方位监控疫苗,包括IV期试验、疫苗不良事件报告系统和疫苗安全性数据收集对比等。
8、Phase IV Trials 第四期临床试验(非强制性),大部分药厂在疫苗上市后还会选择性继续进行第四期临床试验,来测试疫苗的安全性、功效和其他潜在用途。